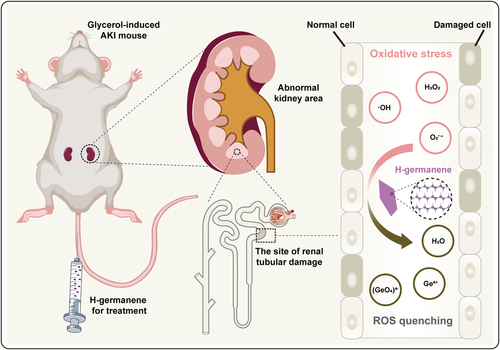
急性肾损伤(acute kidney injury, AKI)是一种由异常活性氧代谢引起的突发性肾功能障碍,临床死亡率高。ROS清除剂的快速发展为AKI治疗提供了新机遇。
2022年10月6日,中国科学院,同济大学等多单位合作,施剑林、林翰及宗明共同通讯在Advanced Science 在线发表题为“Hydrogenated Germanene Nanosheets as an Antioxidative Defense Agent for Acute Kidney Injury Treatment”的研究论文,该研究报道将氢封端的锗烯(H-germanene)纳米片作为小鼠AKI抗氧化防御的纳米平台。
模拟结果表明,2D H-germanene可以通过自由基吸附和后续的氧化还原反应有效清除活性氧。H-germanene在受损的肾脏中表现出高蓄积性,为治疗肾脏疾病提供了有利的机会。在甘油诱导的鼠AKI模型中,H-germanene以强有力的抗氧化保护应对ROS攻击,以维持正常的肾功能指标,在体内没有负面影响。活体动物中这种积极的体内抗氧化防御证明了H-germanene纳米平台是一种强有力的抗AKI和各种抗炎疾病的抗氧化剂。

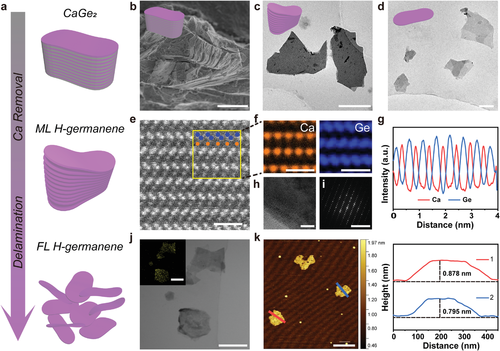
急性肾损伤(AKI),以前称为急性肾衰竭,主要特征是肾功能恶化,包括肾小球滤过率下降和血液含氮废物异常积累。作为各种疾病(如肿瘤、尿毒症和新冠肺炎)的常见并发症,AKI具有较高的发病率和死亡率,尤其是长期住院和重症患者。目前根据病情严重程度,一般采用支持性治疗,如肾透析、移植等,仍缺乏高效的AKI治疗和恢复方案。对AKI的深入研究中,研究人员发现AKI的发生伴随着活性氧(ROS)的异常增加,从而导致肾脏损伤,这被认为是最有可能导致AKI的关键原因。因此,ROS清除为AKI治疗提供了一种新的潜在解决方案。用于炎性疾病(包括急性肝损伤和急性肾损伤)的几种经典抗氧化剂,如N-乙酰半胱氨酸、氨磷汀和乙酰左旋肉碱具备一定的治疗效果,但这些可能会诱发代谢快、利用率低和功效低等副作用。因此,对于AKI治疗来说,具有优异的ROS清除抗氧化能力的生物安全材料系统是非常理想的。图1 H-germanene作为抗AKI活性氧清除剂的示意图(图源自Advanced Science )纳米医学的快速发展丰富了现有的ROS清除方法。各种功能纳米材料(例如二氧化铈和黑色素)已经被开发用于治疗ROS相关疾病,具有令人满意的疗效。然而,除了清除活性氧之外,用于AKI治疗的材料还应表现出肾内富集的靶向能力。根据以前的报道,片状DNA框架具有肾脏靶向功能,可用于药物递送。DNA框架的紧密分层结构可以逃避在松散DNA装配结构的DNA区域中通常观察到的免疫监测和酶水解。此外,带负电荷的DNA框架表面可以减少蛋白质吸附和随后的蛋白质电晕形成,这有利于DNA框架的肾靶向。作为一种新型的2D纳米材料, germanene的几何结构类似于DNA,这可能有助于其在肾脏中的被动积累。此外,由于其形态、尺寸、电子传输和光学性质等物理性质,锗烯在生物医学应用中表现出强大的潜力,包括肿瘤光热治疗。与这些有前途的应用并行的是,越来越多的关注集中在纳米颗粒的毒理学上。然而,对于germanene基纳米材料在生物中的应用关注少于二氧化硅和二氧化铈等材料,并且其通过ROS耗尽的抗氧化行为尚未得到广泛研究。氢化是调节用于治疗的纳米催化剂带隙的有效方法,例如用于肿瘤声动力治疗的TiH1.924纳米点和用于肿瘤光动力治疗的氢端的硅纳米片。氢化改变germanene的带隙,使其成为直接带隙的半导体。这种H-germanene可用作电子供体,起到抗氧化剂的作用。图2 H-germanene纳米片的合成与表征(图源自Advanced Science )该研究报道了具有片状DNA几何结构的2D H-germanene纳米片的设计和合成,其可以被动靶向肾脏并消除多种ROS以治疗相关疾病,如AKI。发现H-germanene具有广谱自由基清除作用,即使在相对低的浓度下也能有效地清除过氧化氢、超氧阴离子和羟基自由基。此外,体内和体外实验结果表明H-germanene对AKI治疗的积极作用,且没有显著的毒性。作为一种新型抗氧化剂,这种无机纳米材料具有纳米薄片状的DNA框架,可有效地进行肾脏积累并清除ROS,在AKI治疗中保护肾脏免受ROS损伤。https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202202933